- 首页
-
医疗注塑服务
医疗注塑服务宜泽模具专注于精密医疗注塑模具的研发、设计、制造和销售业务,已发展成为“模塑一体化”规模生产企业,致力于为医疗模具、医疗器械、医药包材、液态硅胶注塑等产品提供解决方案和最终产品。医疗植入注塑宜泽模具专注于精密医疗注塑模具的研发、设计、制造和销售业务,已发展成为“模塑一体化”规模生产企业,致力于为医疗模具、医疗器械、医疗耗材、医药包装等产品提供解决方案和最终产品。液态硅胶注塑宜泽模具专注于精密医疗注塑模具的研发、设计、制造和销售业务,已发展成为“模塑一体化”规模生产企业,致力于为医疗模具、医疗器械、医疗耗材、医药包装等产品提供解决方案和最终产品。医疗器械注塑宜泽模具专注于精密医疗注塑模具的研发、设计、制造和销售业务,已发展成为“模塑一体化”规模生产企业,致力于为医疗模具、医疗器械、医疗耗材、医药包装等产品提供解决方案和最终产品。医药包材注塑宜泽模具专注于精密医疗注塑模具的研发、设计、制造和销售业务,已发展成为“模塑一体化”规模生产企业,致力于为医疗模具、医疗器械、医疗耗材、医药包装等产品提供解决方案和最终产品。清洗组装配套

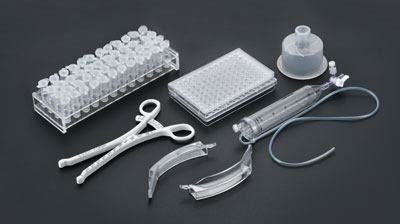

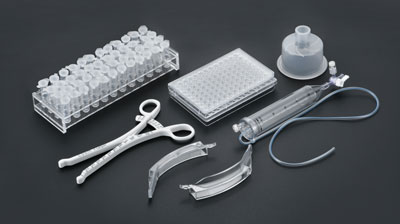
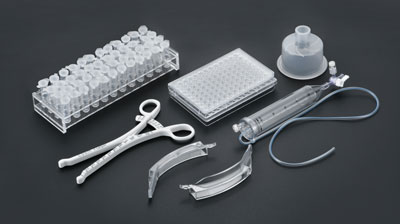
- 精密医疗模具
- 生产实力
- 品质管理
-
关于宜泽
关于宜泽宜泽模具始终以技术导向为核心, 集精密模具研发设计生产制造为一体,并逐步拓展精密医疗模具、医疗无尘注塑、液态硅胶开模注塑加工制造企业。发展历程自公司创立以来,宜泽模具始终以技术导向为核心, 集精密模具研发设计生产制造为一体,并逐步成为精密医疗模具、医疗产品、氟制品专业制造企业。企业文化自公司创立以来,宜泽模具始终以技术导向为核心, 集精密模具研发设计生产制造为一体,并逐步成为精密医疗模具、医疗产品、氟制品专业制造企业。人才理念自公司创立以来,宜泽模具始终以技术导向为核心, 集精密模具研发设计生产制造为一体,并逐步成为精密医疗模具、医疗产品、氟制品专业制造企业。宜泽资讯本栏目提供宜泽模具公司最新资讯动态以及关于医疗模具和医疗塑胶产品注塑相关知识解答





- 联系宜泽








 首页
首页




